石墨烯抗菌抗病毒研究进展
金秀龙 博士
上海烯望材料科技有限公司
【引言】
近年来,各种抗生素药物的滥用导致致病细菌和病毒出现了顽强的耐药性,因此,开发设计新的广谱高效、低成本、低风险和简单易得的抗菌抗病毒成分就显得尤为重要[1]。金属和碳纳米材料凭借其合成简单、结构性能高度可调、抗菌性能优异等特性已经被广泛的应用到抗菌抗病毒领域[2,3]。石墨烯及其衍生物作为一类重要的新兴二维多功能纳米材料,以其优异的广谱抗菌抗病毒能力、不会诱导细菌产生耐药性、制备工艺简单、较好的生物相容性等优点[4,5],相对于传统抗菌抗病毒成分,在生物医学、家居纺织、建筑工程等领域均表现出良好的应用潜力。
【石墨烯材料抗菌抗病毒机制】
石墨烯是一种由碳原子以sp2杂化轨道组成六角型蜂巢晶格的二维碳纳米材料。石墨烯及其衍生物,如石墨烯(G)、氧化石墨烯(GO)和还原氧化石墨烯(rGO),均具有独特的二维表面化学结构和尖锐的物理边缘结构,其中,GO是目前研究最多的一类抗菌抗病毒石墨烯材料[6,7]。根据报道,石墨烯材料的抗菌抗病毒能力主要基于以下几种机制的混合协同作用:1)物理切割,也称纳米刀(Nano-Knives),石墨烯材料尖锐物理边缘可有效切割细菌病毒表面,破坏细胞壁和膜结构,造成胞内物质泄漏和代谢紊乱,最终导致细菌病毒死亡,是石墨烯材料的主要抗菌抗病毒机制之一[8,9];2)膜表面成分提取(Insertion and Extraction),石墨烯材料具有大的比表面积和疏水性,可以有效通过接触或插入方式吸附结合细菌病毒表面的磷脂分子,从而破坏其细胞膜结构引起细菌病毒死亡[10];3)物理捕获(Wrapping),石墨烯材料会通过包裹方式将细菌同周围介质隔离,进而阻断其增殖,起到抑菌作用[11];4)氧化应激作用(ROS),在同细菌接触过程中,石墨烯表面缺陷和尖锐的边缘结构均会诱导细菌产生活性氧成分,从而导致其正常生理代谢紊乱,造成细菌死亡[12,13](图1)。除了上述主要抗菌抗病毒机制外,电荷传导也是重要的石墨烯抗菌机制,该机制通过石墨烯传导细菌表面电荷,破坏细胞膜的生理活动和功能,造成细菌代谢紊乱,进而促进细菌死亡[14]。
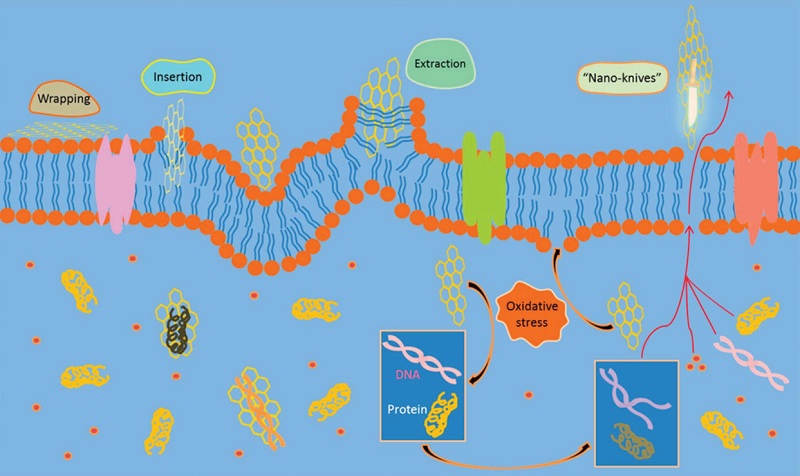
图1.石墨烯材料抗菌主要机制[7]
【石墨烯材料抗菌抗病毒研究现状】
2010年以来,基于石墨烯良好的抗菌性能,大量有关石墨烯及其复合抗菌材料的研究工作被报道,进一步证实了石墨烯材料在抗菌方面应用的巨大潜力。同时作为新的应用方向,石墨烯材料的抗病毒作用也被逐渐关注并表现出了良好抗病毒应用能力[15]。目前,关于石墨烯材料的抗菌抗病毒的具体性能仍然存在一定的争议[16]。根据报道和烯望公司自身实验抗菌测试结果,表明部分石墨烯材料抗菌性能对不同种类或类型的细菌或病毒表现出一定的选择性,具体表现为对某些细菌高抗性,对某些抗菌低抗性甚至促进其增殖[17]。这可能与所用石墨烯原料的物理化学性质和细菌本身特点有关。而且,目前实验室和市场上石墨烯种类繁多,质量性能参数存在非常大的差异,这些都对石墨烯材料的抗菌抗病毒应用开发造成了很大阻碍,因此,仍然需要大量的研究工作来进一步完善和明确石墨烯材料具体应用工艺技术。
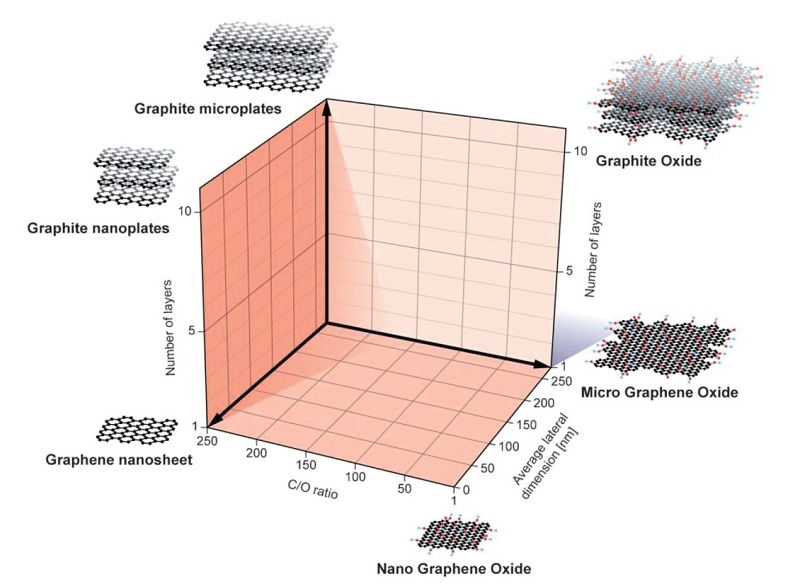
石墨烯材料的抗菌抗病毒性能受到石墨烯材料的物理化学性质、生物因素和非生物因素三者共同影响。石墨烯材料的物理化学性质影响因素主要包括石墨烯的层数、横向尺寸和化学组成(碳氧比)[18](图2)。研究结果表明,石墨烯的层数越少,抗菌能力越强,这可能与石墨烯比表面积的增大、缺陷增多、边缘切割作用变强有关[19]。陈元等人通过将不同横向尺寸的GO同大肠杆菌混合培养,发现GO对大肠杆菌的抑菌作用随着GO横向尺寸的增大而增强,这与大尺寸GO更能有效捕获细菌相关[20]。但是,增大的石墨烯材料横向尺寸有可能进一步削弱石墨烯边缘对细菌和病毒的切割作用,进而影响其实际杀伤效果。范丽珍等人研究了不同表面碳氧比石墨烯材料对大肠杆菌的抗菌作用,结果表明氧含量越高,其抗菌能力越强[21]。细菌和病毒本身的结构和生理条件也会对石墨烯材料的抗菌能力产生影响,研究表明,石墨烯材料对革兰氏阳性金黄色葡萄球菌的抗菌性能要优于革兰氏阴性大肠杆菌,这可能与革兰氏阳性和阴性菌的外膜结构特点有关[22]。外部条件,如分散介质、高分子物质、表面电荷等均会对石墨烯材料的抗菌抗病毒能力产生影响[18]。在培养基分散介质中,生物分子会结合包覆石墨烯表面,从而在一定程度上阻断石墨烯与细菌的接触抗菌作用,从而削弱石墨烯材料的抗菌性能[23]。
图
图2.影响石墨烯材料抗菌性能的石墨烯物理化学因素[18]
【烯望科技石墨烯抗菌研发进展】
烯望科技拥有独立自主的石墨烯生产工艺技术,可以制备不同横向尺寸、层数、表面化学组成的各种石墨烯及其衍生物,包括石墨烯、氧化石墨烯、还原氧化石墨烯、石墨烯量子点等。同时,在公司现有石墨烯原料基础上,公司进一步开发了一系列石墨烯复合纤维产品。基于上述石墨烯原材料和复合纤维技术,参考国家抗菌测试标准,烯望科技对石墨烯及其衍生物和复合纤维的抗菌性能进行了系统性的测试,详细抗菌测试性能见表1。从表中数据可以看出,不同横向尺寸的水溶性石墨烯对大肠杆菌和金黄色葡萄球菌表现出不同的抗菌性能,且不具有明确的规律。水溶性氧化石墨烯对大肠杆菌和金黄色葡萄菌的抗菌效果比较接近,且其抗菌性能要优于水溶性石墨烯,这可能是由于氧化石墨烯含氧量高,可以通过氧化应激作用显著提高其抗菌性能,见图3,采用菌落计数法评估氧化石墨烯抗菌性能。不同化学结构组成的石墨烯量子点也表现出差异性抗菌作用,氨基外侧石墨烯量子点可促进大肠杆菌增殖,而氨基内侧高氮掺杂石墨烯量子点则对其表现出较强的抑制作用。总体上石墨烯材料均对金黄色葡萄球菌表现出较强到弱的抗菌作用,而对于大肠杆菌,抗菌性能受到材料本身物理化学性质影响变动很大,从较强抗菌到促进增殖均有出现,这些结果表明选择合适的石墨烯原料对于获得良好的抗菌能力极为重要。

图3. 采用菌落计数方法观察石墨烯材料抗菌性能
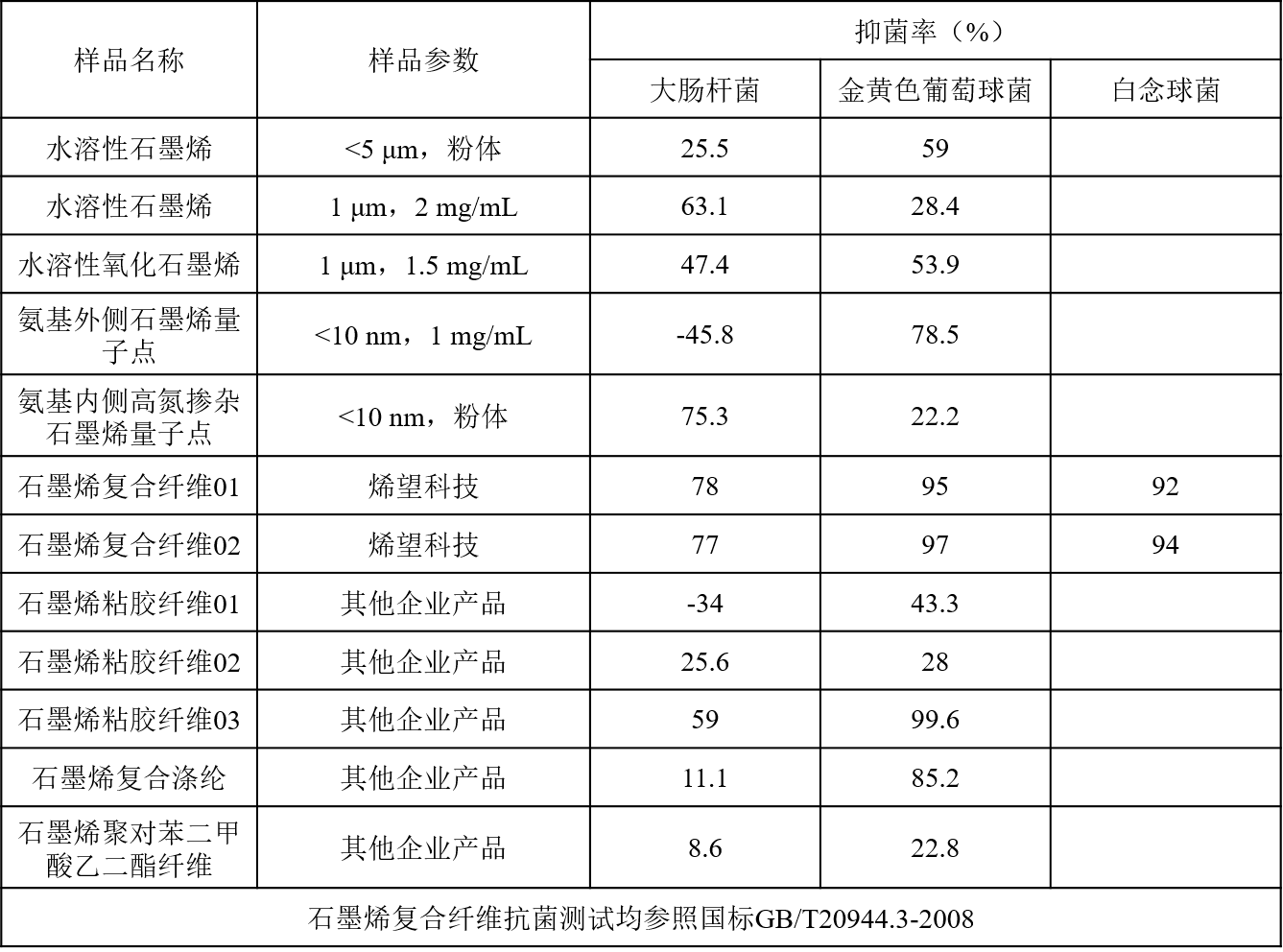
表1. 烯望科技石墨烯材料及其复合纤维抗菌性能测试
对于石墨烯复合纤维,烯望科技通过优化石墨烯原料抗菌性能,加工得到抗菌性能优异的石墨烯复合纤维,对金黄色葡萄球菌和白念球菌的抑菌率达到90%以上,对大肠杆菌也表现出75%的抑菌率,检测报告见图4。烯望科技也对市场上其他石墨烯企业的石墨烯复合纤维产品进行了测试,测试结果显示不同厂家的石墨烯复合纤维对于大肠杆菌的抗菌性能均不够理想,远低于70%抑菌率。仅有两家的石墨烯复合纤维对于金黄色葡萄球菌表现出良好的抗菌能力,分别为99.6%和85.2%。综上,通过同市场上现有产品进行比对,发现市场现有石墨烯复合纤维的实际抗菌性能均远低于生产厂家宣传的抗菌能力。因此,烯望科技的石墨烯复合纤维具有非常明显的抗菌优势。
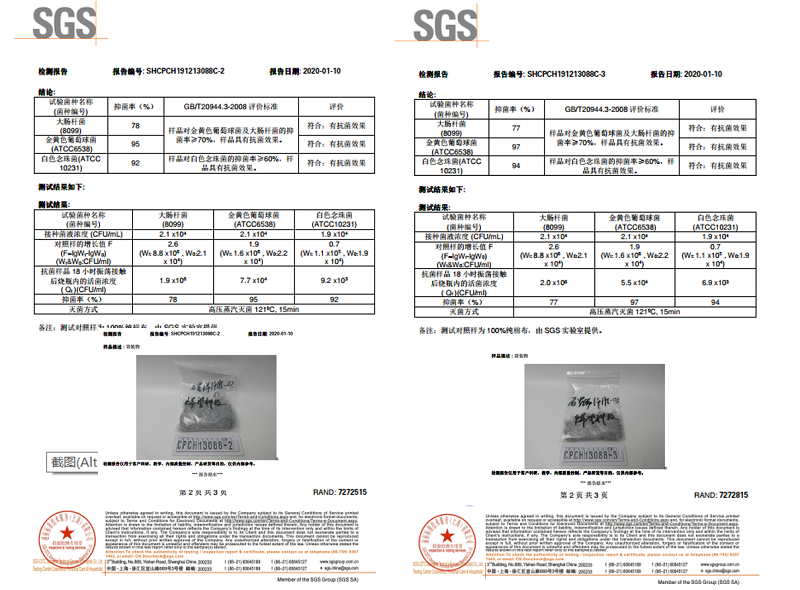
图4. 烯望科技石墨烯复合纤维抗菌检测报告
烯望科技的紧密合作单位中科院上海微系统所石墨烯粉体课题组也开展了石墨烯在生物医药应用领域的研究,包括石墨烯量子点材料的荧光特性、生物相容性、肿瘤标识和治疗、特定肿瘤快速诊断等,相关论文有:
1) Emancipating target-functionalized carbon dots from autophagy vesicles for a novel visualized tumor therapy, Advanced Functional Materials 28 (2018) 1800881.
该工作实现了石墨烯衍生物在肿瘤细胞中的靶向富集,进一步的研究发现,该材料触发了肿瘤细胞的自噬保护机制,该机制可能为肿瘤耐药性的产生原因。鉴于此,通过石墨烯衍生物与自噬抑制药物联用,实现了肿瘤细胞的靶向高效杀灭。裸鼠皮下肿瘤模型实验结果表明,上述治疗方案在15天中使肿瘤体积显着减小(肿瘤包块缩小75%),相比传统化疗药物其效率提升3-4倍(图5)。与此同时,由于高效的靶向能力,治疗过程中毒副作用显着下降。在动物模型中未发现明显全身毒性和器官损伤。该项研究为当前肿瘤治疗技术中遇到的实时监控、高靶向率治疗、抗耐药性三大难点提供了新的思路和有效的解决方案。

图5. 基于石墨烯量子点的肿瘤靶向治疗方案
2) A new graphene derivative: hydroxylated graphene with excellent biocompatibility, ACS Applied Materials & Interfaces 8 (2016) 10226-10233.
该工作表明亲水石墨烯材料可有效促进干细胞增殖(图6),证明了该材料是一种潜在的干细胞体外增殖基质,其对干细胞增值过程的有效促进为干细胞治疗过程中脂肪干细胞体外扩增技术提供了材料学支持。
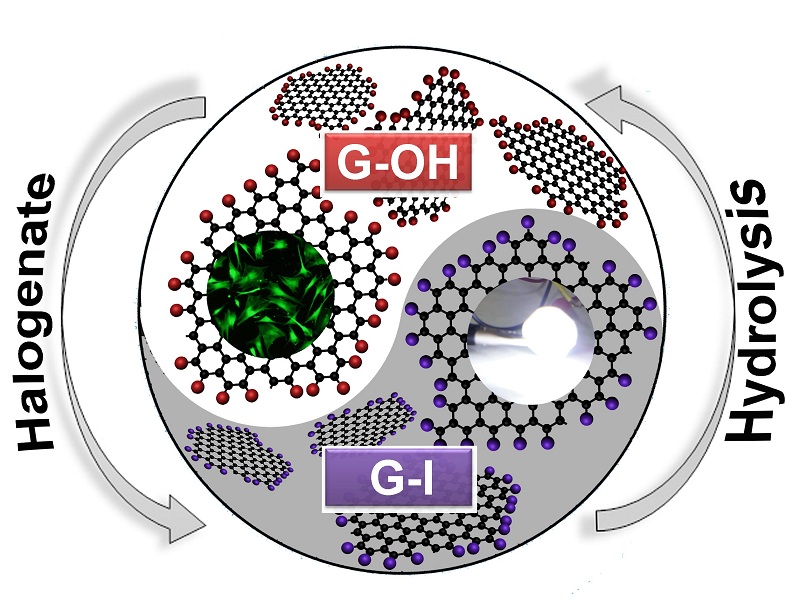
图6. 亲水石墨烯材料对脂肪干细胞增殖的促进
3) Selenium doped graphene quantum dots as an ultrasensitive redox fluorescent switch, Chemistry of Materials 27 (2015) 2004-2011.
该工作利用石墨烯材料对细胞代谢过程中重要的氧化还原过程实现了实时的长效原位荧光监控,为深入理解细胞代谢过程、肿瘤化过程提供了有力的监测与研究手段。
【石墨烯材料抗菌抗病毒产品形态】
基于已有文献报道和市场产品信息,石墨烯材料的抗菌抗病毒主要有以下几种产品形态:1)胶体溶液[24],包括石墨烯及其衍生物单独体系、石墨烯复合其他协同抗菌抗病毒成分的混合体系,主要通过直接接触和缓慢释放对细菌和病毒起到有效杀伤;2)涂层[25],可以将石墨烯或其复合抗菌抗病毒材料采用物理沉积或其他方式涂覆结合到产品表面,进而通过表面接触过程有效起到抗菌抗病毒作用;3)复合凝胶[26],在凝胶制备过程中,以掺杂或者化学键合的方式加入石墨烯抗菌抗病毒成分,使其同时具备凝胶和石墨烯二者的功能;4)复合纤维[27],将石墨烯或改性石墨烯抗菌抗病毒材料在纺丝过程中掺加到纺丝溶液中,从而通过传统纺丝工艺制备得到性能优异的多功能性复合石墨烯纤维。
【石墨烯材料抗菌抗病毒应用领域】
目前,石墨烯抗菌抗病毒已经被广泛的应用在生物医学、家居纺织、建筑工程、空气过滤、水质净化、美容化妆品等领域,见图7。
生物医学领域,包括石墨烯医用抗菌绷带、医用凝胶、骨科和牙科移植材料抗菌涂层[18]等。如石墨烯医用抗菌绷带可以有效促进皮肤创口或手术创口的愈合[28]。骨移植材料可以有效提供抗菌屏蔽同时促进移植部位的细胞增殖,加快组织器官恢复。
家居纺织,包括石墨烯消毒液、石墨烯纺织用品等,石墨烯消毒液可以通过喷洒等方式起到有效的抗菌抗病毒作用。石墨烯纺织用品包括石墨烯抗菌纤维及其下游产品,如抗菌面料、抗菌服装和内衣、抗菌地毯、床上用品等,可以起到很好的日常防护作用。
建筑工程,石墨烯抗菌抗病毒材料可以作为涂层对建筑表面进行有效的防护。如桥梁、公共设施表面的金属抗菌防护,可以通过石墨烯材料有效实现,同时还可以起到耐腐蚀作用[29]。家居墙壁也可以通过石墨烯抗菌涂层实现对家人的防护。
空气过滤,通过添加石墨烯抗菌抗病毒成分,改善传统空气滤材的抗菌抗病毒能力,同时显著提高过滤性能。
水质净化,可以有效消灭水中细菌病毒,吸附有害物质,提高水质过滤质量。
美容化妆品,石墨烯掺杂可以为面膜或化妆品乳液等成分提供抗菌抗病毒防护。

图7.石墨烯材料抗菌抗病毒应用
【国内石墨烯材料抗菌抗病毒市场情况】
目前,国内石墨烯抗菌抗病毒市场仍主要集中在石墨烯抗菌产品应用领域,抗病毒应用由于研究规模和时间落后于抗菌,仍处于初级阶段。主要的企业包括南通强生、恒利宝、上海烯望、深圳烯旺、山东圣泉、新奥、标点纺织、陕西金瑞烯、上海康烯莱等,其中大多数企业聚焦在石墨烯复合抗菌纤维和纺织品领域。现阶段国内市场石墨烯抗菌产品主要有健康理疗、家居纺织、生物医学、美容化妆品等几个方面。其中健康理疗涉及护颈、护膝等产品,起到抗菌和保健功能。家居纺织主要包括服装、内衣、被褥、地毯、窗帘等日常产品,在抗菌的同时实现远红外、抗紫外等多功能性。生物医学领域仍然处于研发产品转化阶段,需要大量的技术和临床工作来进行产品定型。美容化妆品领域在石墨烯面膜方面首先取得突破,并取得了一定的市场规模。但是,由于缺少明确的国家质量标准和监管体系,目前国内的石墨烯抗菌产品质量性能参差不齐,虚假和真实产品并存,不少产品抗菌宣传效果与实测效果不符。
烯望材料基于自有高质量石墨烯工艺技术,开发了一系列石墨烯复合抗菌纤维,包括石墨烯复合黏胶纤维、涤纶等,通过国家标准抗菌检测,均表现出良好的抗菌性能,并在床上用品、服装等产品开发领域取得了一定的进展。目前,公司继续加大对于石墨烯复合抗菌纺织产品的研发和投资力度,在保证良好的抗菌性能基础上,实现更多的功能性,满足市场和消费者日益增长的定制化需求。
【石墨烯材料抗菌抗病毒市场展望】
虽然国内石墨烯抗菌抗病毒市场仍不够成熟,但是石墨烯抗菌应用已经展现了强大的市场潜力和消费者接受度。随着逐渐增加和完善的石墨烯抗菌抗病毒研究,以及产品工艺优化、产品质量标准的建立和市场的不断开拓,石墨烯材料抗菌抗病毒会在日常生活中发挥更加关键的作用。
【参考文献】
1) X.P. Wang, X. Liu, H, Han., Evaluation of antibacterial effects of carbon nanomaterials against copper-resistant Ralstonia solanacearum. Colloids and Surfaces B: Biointerfaces. 2013, 103: 136-142.
2) H. Zheng, R. Ma, M. Gao, X. Tian, Y. Q. Li, L. Zeng, R. Li., Antibacterial applications of graphene oxides: structure-activity relationships, molecular initiating events and biosafety. Science Bulletin. 2018, 63: 133-142.
3) P. C. Henriques, I. Borges, A.M. Pinto, F.D. Magalhaes, I.C. Goncalves., Fabrication and antimicrobial performance of surfaces integrating graphene-based materials. Carbon. 2018, 132: 709-732.
4) M.Y. Xia, Y. Xie, C.H. Yu, G.Y. Chen, Y.H. Li, T. Zhang, Q. Peng., Graphene-based nanomaterials: the promising active agents for antibiotics-independent antibacterial applications. Journal of Controlled Release. 2019, 307: 16-31.
5) B. Ziem, J. Rahn, I. Donskyi, K. Silberreis, L. Cuellar, J. Dernedde, G. Keil, T.C. Mettenleiter, R. Haag., Polyvalent 2D Entry Inhibitors for Pseudorabies and African Swine Fever Virus. Macromolecular Bioscience. 2017, 6:1600499.
6) 绍文尧, 闫梦文,谢全灵。氧化石墨烯抗菌机理研究进展。化工技术与开发。2016,10:32-39.
7) H.E. Karahan, Y. Wang, W. Li, F. Liu, L. Wang, X. Sui, M.A. Riaz, Y. Chen., Antimicrobial graphene materials: the interplay of complex materials characteristics and competing mechanisms. Biomaterials Science. 2018, 6:766-773.
8) S. Ye, K. Shao, Z. li, N. Guo, Y. Zuo, Q. Li, Z. Lu, L. Chen, Q. He, H. Han., Antiviral Activity of graphene Oxide: How Sharp Edged Structure and Charge Matter. ACS Applied Materials & Interfaces. 2015, 7:21571-21579.
9) V. Palmieri, M. Papi, C. Conti, G. Ciasca, G. Maulucci, M.D. Spirito., The future development of bacteria fighting medical devices: the role of graphene oxides. Expert Review of Medical Devices. 2016, 11: 1013-1019.
10) V.T.H. Pham, V.K. Truong, M.D.J. Quinn, S.M. Notley, Y. Guo, V.A. Baulin, M.A. Kobaisi, R.J. Crawford, F.P. Ivanova., Graphene Induces Formation of Pores that Kill Spherical and Rod-Shaped Bacteria. ACS Nano. 2015, 8: 8458-8467.
11) F. Perreault, A.F.D. Faria, S. Najati, M. Elimelech., Antimicrobial Properties of Graphene Oxide nanosheets: Why Size Matters. ACS Nano. 2015, 7: 7226-7236.
12) S. Liu, T.H. Zeng, M. Hofmann, E. Burcombe, J. Wei, R. Jiang, J. Kong, Y. Chen., Antibacterial Activity of Graphite, Graphite Oxide, Graphene Oxide, and Reduced Graphene Oxide: Membrane and Oxidative Stress. ACS Nano. 2011, 9: 6971-6980.
13) S. Gurunathan, J.W. Han, A.A. Dayem, V. Eppakayala, M.R. Park, D.N. Kwon, J.H. Kim., Antibacterial activity of dithiothreitol reduced graphene oxide. Journal of Industrial and Engineering Chemistry. 2013, 19: 1280-1288.
14) J. Li, G. Wang, H. Zhu, M. Zhang, X. Zheng, Z. Di, X. Liu, X. Wang., Antibacterial activity of large-area monolayer graphene film manipulated by charge transfer. Scientific Reports. 2014, 4: 4359.
15) A.R. Deokar, A.P. Nagvenkar, I. Kalt, L. Shani, Y. Yeshurum, A. Gedanken, R. Sarid., Graphene-Based “Hot Plate” for the Capture and Destruction of the Herpes Simplex Virus Type 1. Bioconjugate Chemistry. 2017, 28: 1115-1122.
16) H.M. Hegab, A. ElMekawy, L. Zou, D. Mulcahy, C.P. Saint, M.G. markovic., The controversial antibacterial activity of graphene –based materials. Carbon. 2016, 105: 362-376.
17) O.N. Ruiz, K.A.S. Fernando, B. Wang, N.A. Brown, P.G. Luo, N.D. Mcnamara, M. Vansness, Y.P. Sun, C.E. Bunker., Graphene Oxide: A Nonspecific Enhancer of Cellular Growth. ACS Nano. 2011, 10: 8100-8107.
18) H.E. Karahan, C. Wiraja, C. Xu, J. Wei, Y. Wang, L. Wang, F. liu, Y. Chen., Graphene Materials in Antimicrobial Nanomedicine: Current status and Future Perspectives. Advanced Healthcare Materials. 2018, 7: 1701406.
19) J. Qiu, H. Geng, D. Wang, S. Qian, H. Zhu, Y. Qiao, W. Qian, X. Liu., Layer-Number Dependent Antibacterial and Osteogenic Behaviors of graphene Oxide Electrophoretic Deposited on Titanium. ACS Applied Materials & Interfaces. 2017, 9: 12253-12263.
20) S. Liu, M. Hu, T.H. Zeng, R. Wu, R. Jiang, J. Wei, L. Wang, J. Kong, Y. Chen., Lateral Dimension-Dependent Antibacterial Activity of Graphene Oxides Sheets. Langmuir. 2012, 28: 12364-12372.
21) M.H. Wang, Q. li, X. Li, Y. Liu, L.Z. Fan., Effect of oxygen-containing functional groups in epoxy/reduced graphene oxide composite coatings on corrosion protection and antimicrobial properties. Applies Surface Science. 2018, 448: 351-361.
22) O. Akhavan, E. Ghaderi., Toxicity of Graphene and Graphene Oxide Nanowalls Against Bacteria. ACS Nano. 2010, 10: 5731-5736.
23) L. Hui, J.G. Piao, J. Auletta, K. Hu, Y. Zhu, T. Meyer, H. Liu, L. Yang., Availability of the Basal Planes of graphene Oxide Determines Whether It Is Antibacterial. ACS Applied Materials & Interfaces. 2014, 6: 13183-13190.
24) W. Hu, C. Peng, W. Luo, M. Lv, X. Li, D. Li, Q. Huang, C. Fan., Graphene-Based Antibacterial Paper. ACS Nano. 2010, 7: 4317-4323.
25) Y. Liu, J. Wen, Y. Gao, T. Li, H. Wang, H. Yan, B. Niu, R. Guo., Antibacterial graphene oxide coatings on polymer substrate. Applied Surface Science. 2018, 436: 624-630.
26) A. Konwar, S. Kalita, J. Kotoky, D. Chowdhury., Chitosan-Iron Oxide Coated Graphene Oxide Nanocomposite Hydrogel: A Robust and Soft Antimicrobial Biofilm. ACS Applied Materials & Interfaces. 2016, 8: 20625-20634.
27) Y. Ma, D. Bai, X. Hu, N. Ren, W. Gao, S. Chen, H. Chen, Y. Lu, J. Li, Y. Bai., Robust and Antibacterial Polymer/Mechanically Exfoliated Graphene Nanocomposite Fibers for biomedical Applications. ACS Applied Materials & Interfaces. 2018, 10: 3002-3010.
28) H. Sun, N. Gao, K. Dong, J. Ren, X. Qu., Graphene Quantum Dots-Band-Aids Used for Wound Disinfection. ACS Nano. 2014, 6: 6202-6210.
29) K. Krishnamoorthy, K. Jeyasubramanian, M. Premanathan, G. Subbiah, H.S. Shin, S.I. kim., Graphene oxide nanopaint. Carbon. 2014, 72: 328-337.